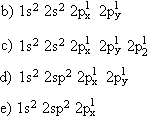AVALIAÇÃO FINAL – I UNIDADE
MATEMÁTICA
1. Na seqüência (1/2, 5/6, 7/6, 3/2,...), o termo de ordem 30 é:
a) 29/2 b) 61/6 c) 21/2 d) 65/6 e) 67/6
2. Se a seqüência (-8,a,22,b,52) é uma progressão aritmética, então o produto a.b é igual a:
a) 273 b) 259 c) 124 d) 42 e) 15
3. As idades inteiras de três irmãos formam uma P.A., e a soma delas é igual a 15 anos. A idade máxima, em anos, que o irmão mais velho pode ter é:
a) 10 b) 9 c) 8 d) 7 e) 6
4. A seqüência (2x + 5, x +1, x/2, ...), com x Æ IR, é uma progressão geométrica de termos positivos. O décimo terceiro termo dessa seqüência é
a) 2 b) 3-10 c) 3 d) 310 e) 312
5. A soma dos múltiplos de 7 compreende entre 100 e 250 é igual a:
a) 3.325 b) 3.850 c) 3.500 d) 3.825 e) 3.675
6. A soma dos 20 elementos iniciais da P.A. (-10,-6,-2,2,...) é:
a) 660 b) 640 c) 600 d) 560 e) 540
FÍSICA
7. Existem duas escalas termométricas que só admitem temperaturas positivas. São elas:
a) Celsius e Fahrenheit. b) Fahrenheit e Kelvin. c) Kelvin e Rankine.
d) Rankine e Reaumur. e) Reaumur e Celsius.
8. Na embalagem de um produto existe a seguinte recomendação: "Manter a -4° C". Num país em que se usa a escala Fahrenheit, a temperatura correspondente à recomendada é:
a) -39,2°F b) -24,8°F c) 24,8°F d) 39,2°F e) 40,2°F
9. Uma escala termométrica E adota os valores –10ºE para o ponto de gelo e 240ºE para o ponto de vapor. Qual a indicação que na escala E corresponde a 30ºC?
a) 55ºE b) 65ºE c) 66ºE d) 54ºE e) 38ºE
10. Uma ponte de aço tem 1 000 m de comprimento. O coeficiente de dilatação linear do aço é de 11x10-6 ºC-1. Qual a expansão da ponte, quando a temperatura sobe de 0 para 30ºC?
11. O cilindro circular de aço do desenho abaixo se encontra em um laboratório a uma temperatura de -100ºC. Quando este chegar à temperatura ambiente (20ºC), quanto ele terá dilatado? Dado que .
QUÍMICA
12. Um átomo de elemento X apresenta 23 partículas nucleares das quais 12 possuem cargas elétrica igual a zero. Com base nessas informações podemos afirmar que esse átomo X possui.
a) Prótons = 23; nêutrons = 12; elétrons = 12. b) Prótons = 23; nêutrons = 12; elétrons = 23.
c) Prótons = 12; nêutrons = 11; elétrons = 11. d) Prótons = 11; nêutrons = 12; elétrons = 11.
e) Prótons = 11; nêutrons = 12; elétrons = 12.
13. Somando-se todas as partículas (prótons, nêutrons e elétrons) de um átomo de 28Ni59 com as do átomo de 80Hg201, o total de partículas será:
a) 281. b) 158. c) 368. d) 108. e) 360.
14. O átomo de telúrio (Te) possui 52 elétrons e 75 nêutrons. O seu número atômico, número de massa e número de elétrons da camada de valência são, respectivamente:
a) 52, 127 e 5. b) 52, 127 e 6. c) 127, 52 e 6. d) 52, 75 e 5. e) 52, 127 e 4.
15. A diferença entre o número de massa de um átomo e o seu número atômico fornece o número de:
a) Prótons. b) Nêutrons. c) Elétrons. d) Mésons. e) Pósitrons.
16. Identifique a alternativa falsa:
a) A soma do número de prótons e nêutrons de um átomo indica o número de massa desse átomo.
a) Um elemento deve ter seus átomos com o mesmo número de nêutrons.
b) Embora os números de massa dos átomos de um mesmo elemento possam variar, seu número de prótons permanece constante.
c) Átomos de um mesmo elemento, com diferentes números de massa, são chamados isótopos.
d) O número de prótons no núcleo de um átomo é conhecido como seu número atômico.
Avance sempre Na vida as coisas, às vezes, andam muito devagar. Mas é importante não parar. Mesmo um pequeno avanço na direção certa já é um progresso, e qualquer um pode fazer um pequeno progresso. Se você não conseguir fazer uma coisa grandiosa hoje, faça alguma coisa pequena. Pequenos riachos acabam convertendo-se em grandes rios. Continue andando e fazendo. O que parecia fora de alcance esta manhã vai parecer um pouco mais próximo amanhã ao anoitecer se você continuar movendo-se para frente. A cada momento intenso e apaixonado que você dedica a seu objetivo, um pouquinho mais você se aproxima dele. Se você pára completamente é muito mais difícil começar tudo de novo. Então continue andando e fazendo. Não desperdice a base que você já construiu. Existe alguma coisa que você pode fazer agora mesmo, hoje, neste exato instante. Pode não ser muito mas vai mantê-lo no jogo. Vá rápido quando puder. Vá devagar quando for obrigado. Mas, seja, lá o que for, continue. O importante é não parar!!! |